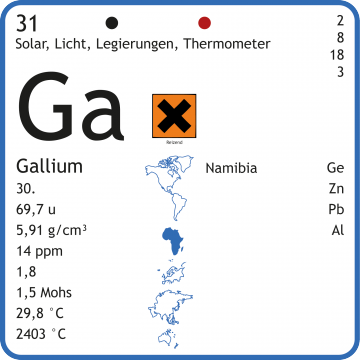
Gallium-Chemie » Nachweis
Eine gute Vorprobe für Gallium ist ein Versuch, bei dem die Boraxperle verwendet wird.
Zuerst glüht man ein Magnesiastäbchen solange aus, bis die Manganeigene charakteristische Eigenfärbung in der Flamme verschwunden ist. Daraufhin nimmt man mit dem Magnesiastäbchen Borax auf und schmilzt dieses Salz in der Flamme des Brenners zu einer glasklaren Perle.
Während diesem Vorgang entweicht das Kristallwasser.
Mit der Perle nimmt man anschließend eine geringe Menge des unbekannten Pulvers auf und hält das Stäbchen erneut in die Flamme.
Hierbei bildet sich, bei Anwesenheit von Gallium ein weißes unschmelzbares Oxid. Gibt man über die Perle daraufhin Cobaltnitrat Co(NO3)2 verfärbt sich die Perle blau bis olivgrün.
Der wohl sicherste Nachweis für Gallium ist die Spektralanalyse.
Wieder verwendet man ein ausgeglühtes Magnesiastäbchen.
Dieses taucht man zur Befeuchtung in einen Tropfen verdünnte Salzsäure. Mit dem Stäbchen nimmt man die Substanz auf und dimmt das Licht, da die Färbung der Flamme im Dunkeln besser zu erkennen ist.
Hält man nun das Stäbchen mit der Spitze in die Flamme eines Bunsenbrenners ändert sich die Farbe der Flamme. Sie leuchtet violett.
Diese Flammenfärbung ist charakteristisch für Gallium.
Bereits durch das geringe Einbringen von leicht flüchtigen Verbindungen, wie beispielsweise Chloride in die Bunsenflamme wird die Emission angeregt.
Im Spektroskop sind zwei Spektrallinien erkennbar. Eine bei 403,3 nm und eine zweite bei 417,2 nm.
Für eine quantitative Analyse fällt man Gallium mit Ammoniak als Galliumhydroxid aus und verglüht es zu Galliumoxid.